今回のパブリック・コメントは、第一段階となっています。締切6月29日までとなっています。
本記事はシリーズ最終の5回目「施用罪と今後」について述べていきます。
【募集開始】医療従事者/CBD製品事業者などの現場の声を届ける機会です。
https://hemptoday-japan.net/16244
THC残留限度値の低い値の原因は、尿検査を考慮した結果
検討委員会の報告書では、
「CBD 製品中の THC 残留限度値については、栽培する大麻草に係るTHC 含有量とは位置付けが異なることに留意した上で、欧州における規制を参考に、保健衛生上の観点から、THC が精神作用等を発現する量よりも一層の安全性を見込んだ上で、上記(2)②イ)における尿検査による大麻使用の立証に混乱を生じさせないことを勘案し、適切に設定すべきである。」
引用:大麻規制検討委員会報告書 https://www.mhlw.go.jp/content/11121000/001002508.pdf
この文言を受けて、下記の値が提示されていると推察されます。
厚労省方針:3区分で管理する
- オイル(10㎎/㎏:0.001%、10ppm)
- 飲料(0.1㎎/㎏:0.00001%、0.1ppm)
- その他のエディブル(食品)、原料、化粧品などの製品(1㎎/㎏:0.0001%、1ppm)
THCの血中濃度制限値(カットオフ値)
海外事例および文献上のTHCの血中濃度はどのようになっているのでしょうか。書籍「カンナビノイドの科学」では次のようになっています。(注1)
|
0 ng/ml |
アメリカ・ワシントン州I-502 16~21歳未満の運転者の基準 |
|
1 ng/ml |
GC-MS分析装置の限界検出値* |
|
<5 ng/ml |
アメリカ・ワシントン州I-502 21歳以上の運転者 |
|
5~6 ng/ml |
医薬品サティベックス 4回/日 健常者 |
|
10~15 ng/ml |
受動喫煙と能動喫煙の境界* |
|
15ng/ml |
2017年までのTHCドーピング規定値 |
|
2.30~28.66ng/ml |
医薬品サティベックス 多発性硬化症の患者 |
|
50ng/ml |
簡易薬物検査キット* 日本の警察で採用 |
|
150ng/ml |
この値を超えるとWADAドーピング成立* |
|
160ng/ml |
マリファナ(33.8㎎)喫煙の最大値(15分後) |
*尿中のTHC-COOH(カルボン酸体THC)
今回の法改正は、Δ9-THCを「麻薬」に位置付ける(麻向法第二条,別表第一第四十二号,第四十三号,第二条第二項)ことによって、麻薬及び向精神薬取締法の施用罪:7年以下の懲役(麻向法第六十六条の二)が適用されることになりました。
そのため、日本の警察で採用されている簡易薬物検査キットは、50ng/mlの陽性を回避するための、製品閾値(カットオフ値)を算出するという考え方になります。(注2)
実際のCBD製品と尿検査の関係とは?
ここでは、CBDオイル(CBD:THC=20:1=CBD 4%、THC 0.18%)のタイプについて、参加者をA~D群+プラセボ群に分けてCBDオイルを6日間摂取、7日間経過観察した場合の薬物動態を研究したレポートを見てみましょう。
各群の1日当たりのCBDとTHCの摂取量
A: 3mL×2, 120 mg CBD, 5.4 mg THC
B: 6mL×2, 240 mg CBD, 10.8 mg THC
C: 9mL×2, 360 mg CBD, 16.2 mg THC
D: 12mL×2, 480 mg CBD, 21.6 mg THC
プラセボ群
*合計43 名の参加者が登録され、5 つの治療グループ(A、n =9; B、n = 8; C、n = 9; D、n = 9; プラセボ、n = 8)のいずれかにランダムに割り振られた。
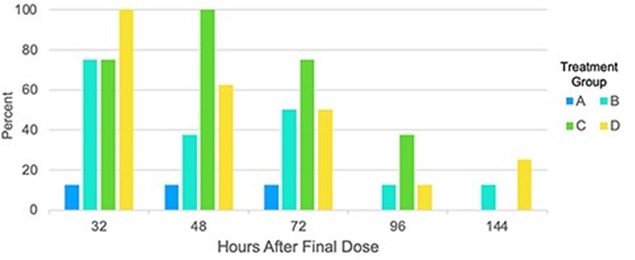
図1 尿検査における11-COOH-THC陽性(>50ng/mL)(注3)
この結果は、7日以内にほとんどの人は定常状態に戻る=THCが検出されません。そして、最もTHCの摂取量が多いDの容量でも概ね安全でした。安全性と忍容性を考慮すると、最初はB以下の用量による分割投与がよいと提案しています。
このレポートがとても優れている点は、大麻使用を測定するための最低基準である基準THC量の1単位=5㎎の摂取に準じているところです。過去50年間の膨大な研究により、Δ9-THCの最小毒性量(LOAEL)を5㎎とするという結論を反映したものです。(注4)
ところが、日本の検討委員会の報告書は、「保健衛生上の観点から、THC が精神作用等を発現する量よりも一層の安全性を見込んだ上で」とわざわざ書いてあるので、この薬物動態の臨床研究から結論づけられた安全性の数値は、全く考慮されないと思われます。
尿検査で全く検出されない値とは?
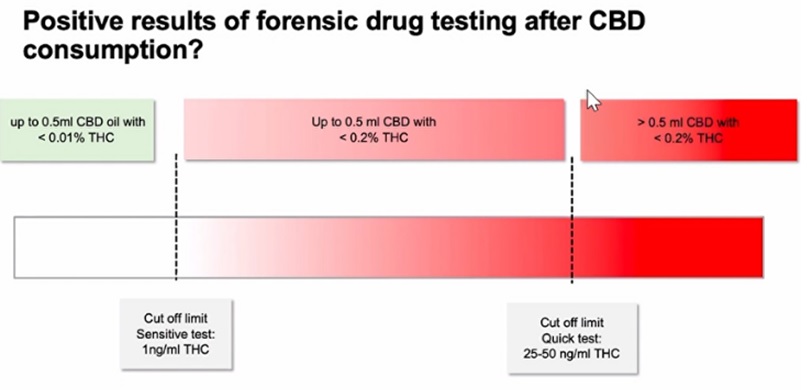
下記では、CBDオイルをスポイト1滴分の0.5mL(上記臨床試験のA群の1/6、D群の実に1/24 !!)摂取したときに、そのTHC濃度が0.2%以上であれば、簡易検査キット(カットオフ値:20~50ng/mL)では陽性になる可能性が高いことを示しており、THC濃度が0.01%(100ppm)未満であれば、精密検査の1ng/mLの水準でも陰性になる可能性が高いことを示しています。

図2:CBD摂取後の法医学的薬物検査の陽性結果の目安(注5)
日本の検討委員会の報告書は、「尿検査による大麻使用の立証に混乱を生じさせないことを勘案」とあるので、日本の簡易薬物検査キットが50ng/mLのカットオフ値なので、次のような基準値のどこかを採用すれば、問題がないことがわかります。
案1:医薬品としてのCBD品質規格におけるTHC制限値(注6)
ドイツ薬局方 DAC/NRF 2020/2 C-052 < 0.1%
欧州薬局方(案)PA/PH/Exp.11/T(21)50ANP <0.1%
米国薬局方(案)USP Draft<0.1%
案2:カンナビジオール (CBD) オイルおよび食品サプリメント中のテトラヒドロカンナビノール (THC) のリスク評価の課題: 上限を導き出すためのアプローチで提案された0.05%
→ 新しい大麻法のパブリック・コメントの論点(2)CBD製品のTHC残留限度値のリンク参照
https://hemptoday-japan.net/16382
案3:英国の保守的なグループによる科学的根拠をまとめた報告書CBD製品のTHC制限値 0.03% (注7)
特に案3は、厚労省が科学的根拠としている欧州食品安全機関(EFSA)の急性参照用量(ARfD)に基づいており、CBD製品の最大1日投与量のTHC濃度0.03%に相当する21μgが閾値となります。
「提案されている0.03%という安全基準は、CBD食品や消費者製品に含まれる規制対象のカンナビノイドの総量を考慮したものであることを推奨します(つまり、Δ9THCよりも一般的ではなく強力ではない他のTHCとCBNを含む)。このレベルのTHCは、THC薬物検査で陽性となる可能性は極めて低いものです。」と報告書に明記されています。
今回の法改正では、Δ9-THCを「痲薬」として使用した安全性と有効性の
ヒトを対象とした臨床試験ができるようになりました。
そのため、今回のTHC残留限度値は、「暫定値」とし、
例示した(CBD:THC=20:1=CBD 4%、THC 0.18%)のタイプの臨床試験を実施して、製品濃度、摂取量、尿検査、精神活性等の副作用の有無までをしっかりと評価することが重要だと思われます。
パブコメ意見例
日本の検討委員会の報告書には、「保健衛生上の観点から、THC が精神作用等を発現する量よりも一層の安全性を見込んだ上で」「尿検査による大麻使用の立証に混乱を生じさせないことを勘案」とあります。
これらの条件を満たすCBD製品のTHC残留限度値は、(案1)CBD医薬品の品質規格に準じた数値:0.1%(1000ppm)、(案2)ドイツの実際のヘンプ食品やCBD製品の実態調査から導き出した暴露量の上限値:0.05%(500ppm)、(案3):英国の保守的なグループによる科学的根拠を求めた報告書によるCBD製品のTHC制限値:0.03%(300ppm)のどれかでよいと思います。
残留限度値を決めるには、例えば、Δ9-THCが100ppm,500ppm,1000ppm,3000ppmを含むCBD製品を使用して、日本人を対象とした臨床試験を実施し、製品濃度、摂取量、尿検査、精神活性等の副作用の関係性を調べるべきです。
それぞれの根拠となる情報:
案1:ドイツ、欧州、米国薬局方(案)によるとTHC制限値は0.1%、大麻由来医薬品成分としてのCBD(カンナビジオール)の規格https://www.dreamnews.jp/press/0000262885/
案2:カンナビジオール (CBD) オイルおよび食品サプリメント中のテトラヒドロカンナビノール (THC) のリスク評価の課題: 上限を導き出すためのアプローチ
https://www.mdpi.com/2078-1547/13/2/32
案3:「CBD製品におけるTHC濃度の健康指針–安全性評価と規制に関する推奨事項:Health Guidance Levels for THC in CBD products-Safety Assessment & Regulatory Recommendations」https://theaci.co.uk/wp-content/uploads/2021/03/Joint-report-CMC-ACI-CPDRG-Health-Guidance-Levels-for-THC-in-CBD-products.pdf
●年●月●日
氏名、住所、メール
次回(秋頃)のパブリック・コメントの第2段階のテーマ
昨年の23年12月に交付された新しい大麻法/麻向法では、2段階の改正がこれから施行されます。
厚労省方針
第一段階 24年10月1日
大麻由来医薬品の施用、施用罪の適用、CBD製品のTHC残留限度値の設定
大麻草研究栽培者免許の施行、分析業務は麻薬研究者(都道府県知事免許)
第二段階 25年3月1日
第一種、第二種、研究者の栽培規制に関すること
この第2段階の具体的な項目は下記の通りです。
・大麻草採取栽培者の報告事項、帳簿記載事項等
・大麻草の種子以外の生育材料(例:挿し木)
・種子の発芽不能処理、発芽可能な種子の譲渡規定、輸入手続き
・大麻草の加工許可(茎、種子の利用以外)の基準、報告事項
・大麻草中のTHC測定法及びサンプリング法
・協力試験検査機関の要件及び届出(登録)について
また、次回も第一段階のパブリック・コメントのように様々な論点が出てくると思うので、それぞれのテーマ別に解説とパブコメ意見例を紹介していきたいと思います。
参考資料
注1:カンナビノイドの科学p127 https://www.amazon.co.jp/dp/4806715018
注2:薬物中毒検出用キット SIGNIFYTM ERの基礎的評価
https://www.sysmex.co.jp/products_solutions/library/journal/vol21_no3/summary01/vol21_3_01.pdf
注3:健康な人におけるCBDオイルの安全性、薬物動態および薬力学的特性(2022)
http://cannabis.kenkyuukai.jp/information/information_detail.asp?id=125675
注4:国際大麻ツールキット(iCannToolkit):大麻使用を測定するための最低基準。基準THC量の1単位=5㎎
http://cannabis.kenkyuukai.jp/information/information_detail.asp?id=122285
注5:北海道ヘンプ協会「第17回ヨーロッパ産業用大麻協会(EIHA)国際会議報告書(2020年)」
https://www.hokkaido-hemp.net/resource.html
注6:ドイツ、欧州、米国薬局方(案)によるとTHC制限値は0.1%、大麻由来医薬品成分としてのCBD(カンナビジオール)の規格
https://www.dreamnews.jp/press/0000262885/
注7:「CBD製品におけるTHC濃度の健康指針–安全性評価と規制に関する推奨事項:Health Guidance Levels for THC in CBD products-Safety Assessment & Regulatory Recommendations」
http://cannabis.kenkyuukai.jp/information/information_detail.asp?id=115383
今回の対象パブコメ
大麻取締法及び麻薬及び向精神薬取締法の一部を改正する法律の施行に伴う関係政令の整備に関する政令案に関する御意見の募集について
案件番号495240036
案の公示日2024年5月30日
受付締切日時2024年6月29日0時0分
所管省庁 厚生労働省
こちらから(外部サイトへのリンク):https://public-comment.e-gov.go.jp/495240036