
今回のパブリック・コメントは第1段階
昨年の23年12月に交付された新しい大麻法/麻向法では、2段階の改正がこれから施行されます。
厚労省方針
第一段階 24年10月1日
大麻由来医薬品の施用、施用罪の適用、CBD製品のTHC残留限度値の設定
大麻草研究栽培者免許の施行、分析業務は麻薬研究者(都道府県知事免許)
第二段階 25年3月1日
第一種、第二種、研究者の栽培規制に関すること
今回のパブリック・コメントは、第一段階となっています。締切6月29日まで
【募集開始】医療従事者/CBD製品事業者などの現場の声を届ける機会です。
https://hemptoday-japan.net/16244
CBD製品のTHC残留限度値
厚労省方針:3区分で管理する
オイル(10㎎/㎏:0.001%)
飲料(0.1㎎/㎏:0.00001%)
その他のエディブル(食品)、原料、化粧品などの製品(1㎎/㎏:0.0001%)
用量反応曲線 毒性量を決めるには?
残留農薬、食品添加物などの有害性のある化学物質の毒性量を決めるために、様々な基準点が提案されています。各国、機関、業界ごとに基準となる毒性量を決めて安全性を担保しています。
様々な基準があるために、厳しくすることもできれば、緩めることもできるという性質を持っています。
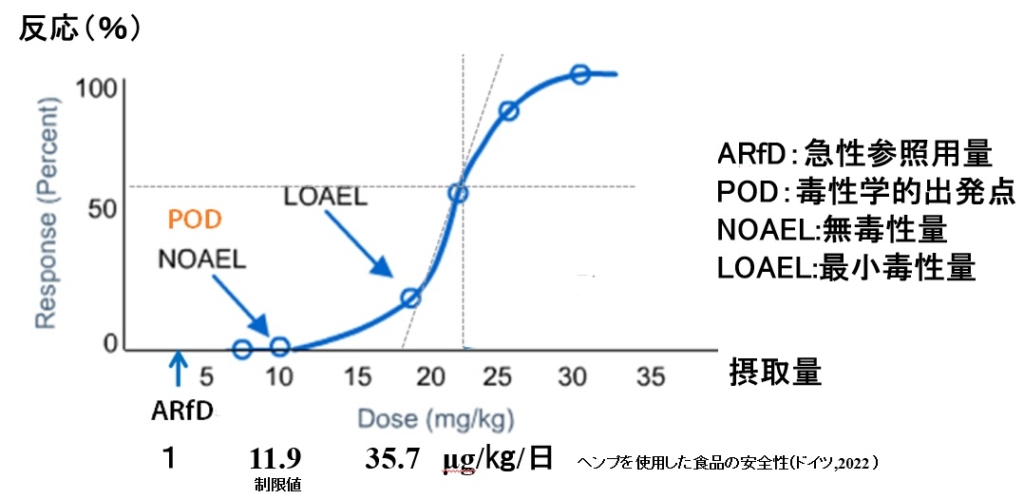
図1 複数ある毒性量の基準点(注1)
厚労省パブコメでは、2015年の欧州食品安全機関(EFSA)のΔ9-THCの急性参照用量(ARfD)1μg/㎏体重を科学的根拠としています。
各国でCBD製品のTHC制限値は、幅があることがわかっています。

図2:各国のCBD製品のTHC制限値(注2)
食品ではなく、医薬品としてのCBDのTHC制限値が下記のように決まっています。
CBD医薬品エピディオレックスは、この基準を順守して製造販売されています。
医薬品としてのCBD品質規格におけるTHC制限値
ドイツ薬局方 DAC/NRF 2020/2 C-052 < 0.1%
欧州薬局方(案)PA/PH/Exp.11/T(21)50ANP < 0.1%
米国薬局方(案)USP Draft < 0.1%
厚生労働省が科学的根拠とした、2015年の欧州食品安全機関(EFSA)のΔ9-THCの急性参照用量(ARfD)1μg/㎏体重は、科学的根拠がないことが、これまで2つのレポートで指摘されていました。
①Position Paper of the European Industrial Hemp Association (EIHA) on Reasonable regulation of
cannabidiol (CBD) in food, supplements, medicine and cosmetics (Update February 2021)
https://eiha.org/wp-content/uploads/2021/02/PPFFSCBD01022021-1.pdf
1)急性参照用量(ArfD)、最小毒性量(LOAEL)が低い
| 機関 | 急性参照用量(μg/㎏/日) |
LOAEL(㎎/日) |
| EFSA(2015) | 1 | 2.5 |
| 欧州産業用ヘンプ協会(EIHA,2021) | 7 | 5.0 |
| オーストラリアとニュージーランド管轄当局 (FSANZ,2011) | 6 | 5.0 |
| スイス連邦公衆衛生局 (SFOPH) | 7 | 5.0 |
2)不確実係数(UF:Uncertainty Factor)が高すぎる
アルコール(未設定)、カフェイン(1)、ニコチン(4.4)、
モルヒネ(3)、コカイン(10)、THC(36)
➁2021年に毒性学の専門雑誌に発表された査読付き論文「A broader view on deriving a reference dose for THC traces in foods」によって10の反論が指摘されています。
https://www.tandfonline.com/doi/full/10.1080/10408444.2021.2008867
1) わずかな数件の小規模な研究のみ
2)精神活性の閾値は、LOAEL 5㎎ (前述)
3)不確実係数(または安全係数)が高すぎ (前述)
4)THC の経口投与量が 5 mg/日未満では重大な悪影響がない
5)種内不確実係数は、10 以下を提案
6)精神活性THCと非精神活性THCAを区別していなかった
7)1µg/kg体重という非現実的に低い
8)リスク評価のエビデンス不足
9) 食品中のTHCによる急性中毒の報告は非常にまれ
10)CBDの割合が優勢であることによるTHC阻害効果の可能性を無視
では、実際に科学的根拠のある値はどこになるのか?
22年7月ドイツ・ノルトライン ヴェストファーレン州化学分析研究所のレポートによると、食品中THC 500 ㎎/㎏ (0.05 %以下)を提案しています。
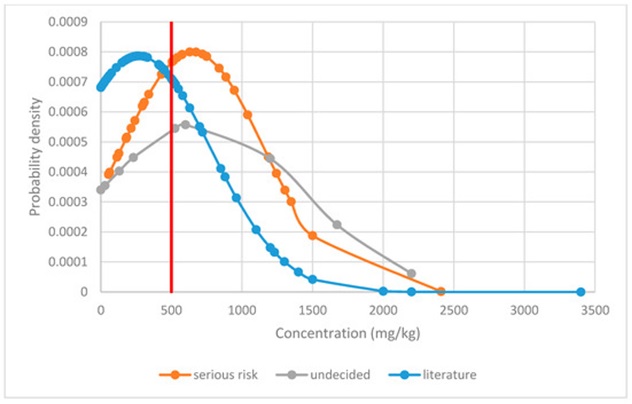
図3:Δ9-THCの重篤なリスクと未決定のリスクレベルと評価されたRASFF(欧州連合内の食品安全問題を報告するためのシステム)のデータを文献データと比較した栄養補助食品中のTHC濃度(注3)
パブコメ意見例
上記の内容を踏まえた、パブコメの回答例を記します。
ご自身で投稿される際に参考にしてみてください。
CBD製品のTHC残留限度値は、科学的根拠が希薄であることが指摘されている数値から算出されています。2015年の欧州食品安全機関(EFSA)のΔ9-THCの急性参照用量(ARfD)1μg/㎏体重は、科学的根拠がないことが2つのレポートで指摘されていました。
①Position Paper of the European Industrial Hemp Association (EIHA) on Reasonable regulation of cannabidiol (CBD) in food, supplements, medicine and cosmetics (Update February 2021)
https://eiha.org/wp-content/uploads/2021/02/PPFFSCBD01022021-1.pdf
➁2021年に毒性学の専門雑誌に発表された査読付き論文「A broader view on deriving a reference dose for THC traces in foods」によって10の反論が指摘されています。https://www.tandfonline.com/doi/full/10.1080/10408444.2021.2008867
ヘンプ食品やCBD製品の使用実態を調査した値から算出した科学的根拠は、22年7月ドイツ・ノルトライン ヴェストファーレン州化学分析研究所のレポートによると、食品中THC 500 ㎎/㎏ (0.05 %以下)を提案しています。
カンナビジオール (CBD) オイルおよび食品サプリメント中のテトラヒドロカンナビノール (THC) のリスク評価の課題: 上限を導き出すためのアプローチ
https://www.mdpi.com/2078-1547/13/2/32
いずれにしても、日本人を使ったCBD製品の摂取に関する臨床データはないため、今後のCBD製品の安全性の確立のため、現在の3区分の上限値は「暫定値」と位置付けるべきだと思います。厚生労働省の方で、臨床試験プロジェクトを立ち上げ、しっかりとした科学的根拠に基づく政策を推進することが重要だと思います。
●年●月●日
氏名、住所、メール
参考資料
注1 ヘンプを使用した食品の安全性(ドイツ,2022 )https://doi.org/10.1108/NFS-04-2022-0129
注2 農業経営者22年11月号「特集:日本の産業用ヘンプ(前編)」
注3 カンナビジオール (CBD) オイルおよび食品サプリメント中のテトラヒドロカンナビノール (THC) のリスク評価の課題: 上限を導き出すためのアプローチ
https://www.mdpi.com/2078-1547/13/2/32
今回の対象パブコメ
大麻取締法及び麻薬及び向精神薬取締法の一部を改正する法律の施行に伴う関係政令の整備に関する政令案に関する御意見の募集について
案件番号495240036
案の公示日2024年5月30日
受付締切日時2024年6月29日0時0分
所管省庁 厚生労働省
こちらから(外部サイトへのリンク):https://public-comment.e-gov.go.jp/495240036
参考リンク
大麻草の栽培の規制に関する法律、麻薬及び向精神薬取締法を一部改正する法律
第一段 未施行 医薬品の解禁と施用罪の適用
https://elaws.e-gov.go.jp/document?lawid=323AC0000000124_20250601_504AC0000000068
第二段 未施行 産業用と医療用の栽培の適正化
https://elaws.e-gov.go.jp/document?lawid=323AC0000000124_20251212_505AC0000000084
















