画像:引用元
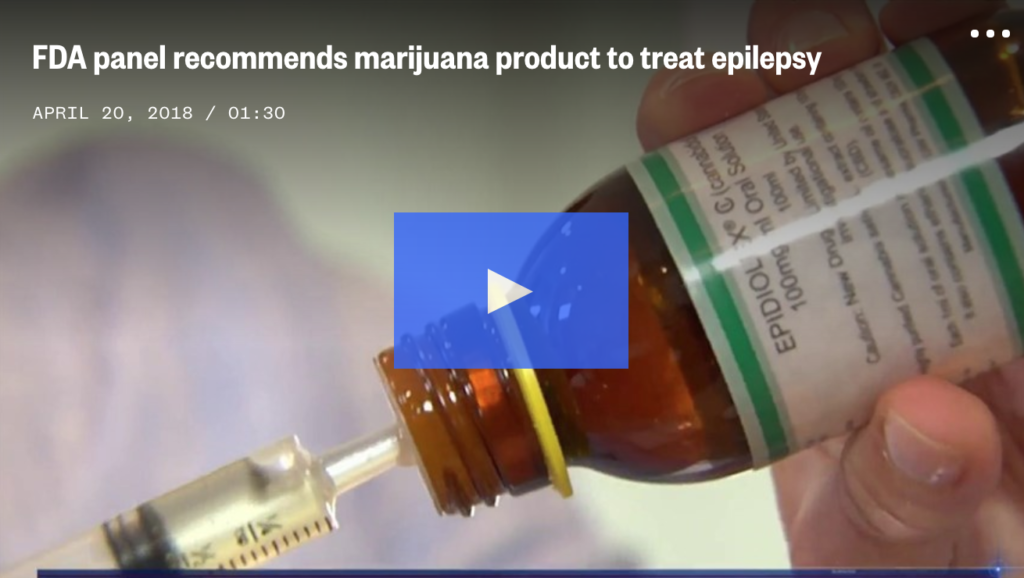
ドラべ症候群やレノックス・ガストー症候群などの難治性てんかんの治療薬として、米国薬物施行局(DEA)に認証された 初の大麻由来の処方薬・CBD製品であるエピディオレックスが、米連邦規制物質のリストから削除されました。
エピディオレックスは、日本においても戦後初の大麻由来製品として臨床試験が計画されています。
*現在の大麻取締法が制定される終戦までは、日本においても大麻は、日本薬局方にも掲載されていた立派な薬でした。

画像:引用元
柔軟性の向上
画像:引用元
同薬の製造元であるGW Pharmaceuticals社は、今回の決定によって、患者がより簡単にエピディオレックスを入手できるようになることを意味すると述べました。
患者は依然として薬を入手するためには医師の処方箋を取得する必要がありますが、州レベルの監視要件の対象ではなくなります。今回の変更により、処方箋は最長1年間有効となり、薬局間で譲渡できるようになりました。
GW PharmaのJustin Gover CEO は声明で、「この変更によって、レノックス・ガストー症候群とドラべ症候群という、最も消耗性のてんかんを患う患者にとって大切な治療であるエピディオレックスの入手が容易になるでしょう」と述べました。
FDAがルールを設定
同社は、「エピディオレックスの流通ネットワークを通じて、これらの変更を州レベルで実行するためのプロセスを開始する」と述べました。
これまでFDAが承認した市販のCBD製品はありませんが、食品や栄養補助食品としての一般的なCBD製品の生産者や再販業者は、不明確な連邦規制スキームの中で、政府当局と小競り合いを続けています。
現在、エピディオレックス以外の米国で販売されているCBD製品は、安全性プロファイルが確立されていないとして、(厳密な意味では)FDAにより違法と見なされています。
現在FDAは、CBDを食品および栄養補助食品として規制する枠組みを設定中であり、CBDのガイダンスを設定中であると述べています。
つまり、医師の処方によって手に入れる事は可能ですが、あくまで厳重な取り扱いを求められる「麻薬」というわけです。 今回の変更によってエピディオレックスは、やっと一般的な薬と同じような扱いとなるわけですが、実際にはエピディオレックスは「ただの高濃度なCBDオイル」ですので、ほぼ同じ内容物のCBD製品が市場には既に沢山出回っています。 つまり、今回の一件から透けて見えるのは、情報化社会の中で目まぐるしく変化している現実に対して、行政の硬直した意思決定のプロセスが全く着いていけてないという事です。 一般消費者からすれば何の変化もない今回の決定ですが、処方薬としてエピディオレックスを受け取る患者には良いニュースですし、何より「行政が一歩現実社会に追いついてきたサイン」と考えられるのではないでしょうか。 Yosuke Koga
Yosuke Koga
記事:引用元