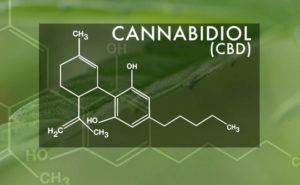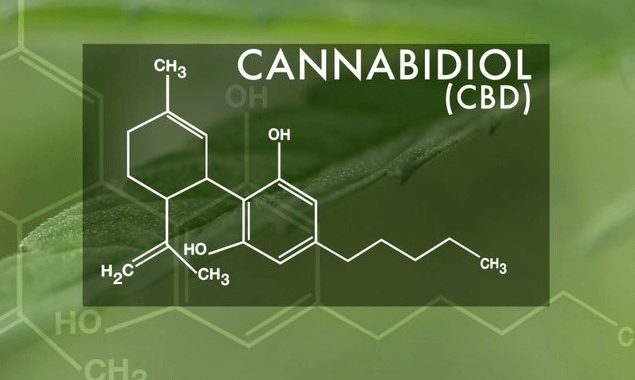
- 先月末、CBDオイル “Epidiolex” が米国で医薬品として承認された。
- これは、大麻由来製品として初の出来事。
先日のGW Pharmaceutical社製のカンナビジオールベースの薬剤Epidiolexの米国における承認は、救済が必要な患者に新たな治療法をもたらすだけでなく、カンナビノイドのさらなる研究とCBDセクターの全体的な拡大を促します。それは、結果として患者に、より多くの治療法の選択肢を提供する良いサイクルを引き起こす可能性がある、とGW社は述べています。
GW社は、2018年6月25日に米国食品医薬品局(FDA)からEpidiolex(2種類の小児てんかんの治療薬として製造された医薬品)の承認を得ました。米国で大麻由来処方薬が連邦から認可を得たのは、初めてのことです。
英国を拠点とするこの上場企業 (*NasdaqGM – GWPH) は、「我が社は、これに続く他のCBD処方薬に道を切り開いている」として、同社がカンナビノイド系医薬品市場を独占しようとしているという一部の批評家からの批判に対して一貫して反論していますが、一方で、処方薬ではない他のCBD製品との違いが消費者にとって不明瞭である為、市場の混乱を招いています。
根拠の無い恐怖
これについて批評家は、GW社が保持する幅広い特許と、同製品がオーファンドラッグ(希少疾病用医薬品)として指定されている状態が同社にもたらす保護、を指摘しています。
さらに、非医薬品グレードのCBD製品を製造する他のメーカーでは、CBDを処方箋薬の枠に組み込んでしまえば、急成長中の非処方箋薬であるCBD食品サプリメントセクターの売上に悪影響を与える可能性があることが懸念されています。これに対して、長年にわたり活動を続けるヘンプコンサルタントであるリチャード・ローズ氏は、根拠がない恐怖だと言います。
「食品が、単にサプリメントであるだけでなく、同時に承認された医薬品でもあるという多くの先例がある。この問題は、皆が言うほどには白黒ハッキリしていない。FDAには州内管轄がないので、米国では栄養補助食品サイドには、ほとんど影響を与えないと考えている。」とローズ氏は述べました。
FDAの承認により、カンナビジオールは医師の手が届くようになり、医師はこれを処方し、医療保険の対象とすることができるようになります。「CBDを処方し、それが保険によって支払われるは良いことだ」とローズ氏は言います。
EIHAの推奨事項への適合
Epidiolexは現在、EU内の当局からも審査中であり、これに対する欧州産業用ヘンプ協会(EIHA)の一般的な勧告は、高用量のCBDが医薬品とみなされるべきであるという考えを支持するもので、「また、そのように規制されるべきである」としています。同協会のCBDへのアプローチはまた、食品サプリメント市場へのいかなる悪影響も予測していないと思われ、 EIHAは、CBDを医薬品(高用量)、市販薬(生理学的用量)および食品クラス(低用量)に分けた3段階規制制度を提案しています。
GW社はこれまで、この高用量の医薬品クラスと、その戦略:特定の品種に由来するカンナビノイドベースの処方箋薬、および特定の疾患を対象とした広範な臨床試験とその連邦承認 – に焦点を当ててきました。
小児てんかんに対処する
Epidiolexは、子供に影響を与える早期発作てんかんの重症形態であるLennox-Gastaut症候群(LGS)およびDravet症候群の治療薬としてFDA承認を取得しました。
この二つの疾患は、それらが引き起こす発作が重篤であることで知られており、その薬剤耐性が特徴です。 LGSの治療には、しばしば数種の幅広い抗てんかん薬が処方されており、これまで、Dravet症候群に対するFDA承認の治療法はありませんでした。
Epidiolexは、臨床試験の進行を受けて、ヨーロッパと米国において既にオーファンドラッグの認証を得ていました。また現在、欧州医薬品庁(EMA)によりLGSとDravet症候群の治療薬として審査中で、2019年初頭にEUで承認される予定です。
GW社のCEOであるジャスティン・ゴバー(Justin Gover)氏は、「この承認(米国)は、てんかんのコミュニティーにおける当社の長年にわたる患者、その家族、および医師とのパートナーシップによって、必要とされている新薬を開発する取り組みの結果です。」と、 FDA承認に続いて出された声明で発表しました。
「これらの患者は、臨床試験で徹底的に研究され、一貫した品質を保証された、医師の診察の下で処方されるカンナビノイド薬を、間も無く手にすることができるのです。」
さらなる承認プロセスの一環として、Epidiolexは、患者に提供される前に、現在の規制物質分類*スケジュールⅠから、スケジュール2または3に変更される必要があり、この見直しは90日以内に起こると予想されています。 GW社は、この薬が2018年秋までに患者に提供されることを期待していると語りました。
*編集局注・規制物質分類とは、主に麻薬等を規制するための枠組み。物質規制法に基づき、乱用の可能性などを基準にスケジュール1から4までのクラス分けを行っている。大麻はスケジュール1に属し、「乱用の可能性が最も高く、医学的利用価値がない」とされてきた。今回のepidiolex承認によって、大麻の医学的な利用価値が認められたのであり、これまでのこうした規制自体に科学的根拠がなかったことが認められた事を意味する。
「ラベル外使用」の可能性
著名な医学雑誌ランセット(Lancet)とニューイングランド・ジャーナル・オブ・メディスン(The New England Journal of Medicine)に掲載された第3相試験では、この薬剤が他の抗てんかん治療に追加された場合に、Dravet症候群およびLGSに関連する発作の頻度を有意に減少させました。
Dravet症候群とLGSに限って承認が得られていますが、今後医師は、CBDが利益をもたらす可能性のある他の症状に対処するために、Epidiolexを「ラベル外使用」として処方する自由があります。
FDAの承認は、今年初めに局内の「末梢および中枢神経系薬物諮問委員会」からの報告書で勧告されたもので、これは委員会メンバー全員が満場一致で支持した勧告でした。
「全体として、3件の第3相試験の結果、CBD経口液剤(CBDオイル)は、現在の抗てんかん薬療法に追加された場合、薬物耐性LGSまたはDravet症候群患者の発作頻度を減少させ、予測可能で管理しやすい安全性プロファイルを維持している。」と、4月の報告書は結論付けました。
他のCBD抽出物は、ヘンプ由来のCBDを合法とした2014年農業法によって、米国で既に広く入手が可能となっています(ただし、マリファナ由来のCBDの販売は禁止されている)。
その結果、2017年だけで3億5,000万ドル以上の売上が見込まれ、2022年には11億ドル以上になるとする業界予測もあります。
GW社の次の動きは?
Epidiolexは、GW社にとってFDA承認のための「有力候補」でしたが、多発性硬化症の症状を緩和するCBD口腔スプレーSativexを含む、同社の他のカンナビノイド系医薬品についても、臨床試験および連邦承認の取り組みが引き続き行われています。
GW社はまた、他の単離したカンナビノイド製剤も検討しています。これには、自閉症スペクトラム障害に向けたカンナビバリンベースの医薬品、グリア芽腫と呼ばれる脳腫瘍の特に悪性の形態や、さらには統合失調症のための他の製剤を含みます。
Epidiolexの患者対費用はまだ発表されていませんが、同社はこれまでの努力に対する十分なリターンを期待しています。アナリストの一部は、健康保険を持たない患者には、Epidiolexは、年間30,000ドルから60,000ドルの費用がかかると予測しています。
1998年に創業した、英国に本拠を置くGW Pharmaceuticals社は、大麻研究およびカンナビノイド系医薬品の開発に積極的に取り組んできました。同社は2007年以来カンナビジオールを研究しています。
Epidiolexは、GW社の米国子会社であるグリニッジバイオサイエンス社によって米国で販売されます。*大塚製薬は、本文中にあるSativexの米国内での製造販売権を2007年から取得していましたが、昨年末にライセンスを解消しました。
– アルネ・ヴェルホフ
(HEMP TODAY 2018年7月3日)
関連記事: